Liberación Sostenida y Tecnología de Peptídos
Vía de señalización del relleno intraarticular ARTHRODESMOL
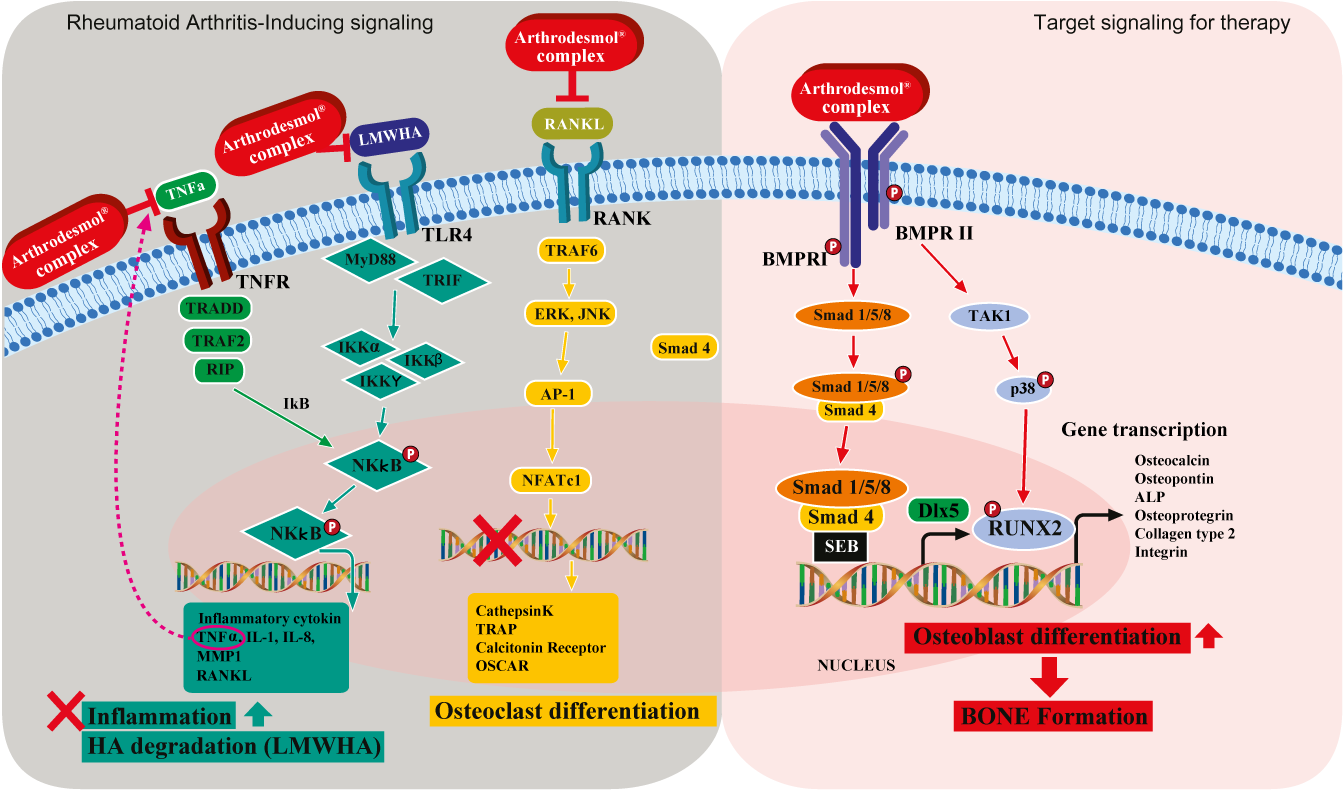
La vía de señalización TNFR activada por TNFα: bloqueada por CG/Inflendina/CG/Flatina (antiinflamación).
A menudo, la artritis, incluyendo la reumatoide, se inicia con la inflamación de la membrana sinovial de la articulación.
La expresión de la citocina inflamatoria, como la TNFα, IL-8, MMP y RANKAL, es fuerte en el tejido inflamatorio.
Un TNFα se enlaza al receptor TNF (TNFR), que da lugar a la expresión de TRADD, TRAF2, RIP.
TRADD, TRAF2, RIP son moléculas de señalización expresadas por el enlace del FNTα a su lugar de enlace, y la expresión de estas moléculas resulta en la fosforilación de NKkB.
Entonces, el NKkB fosforilado promueve la síntesis de las citocinas inflamatorias como TNFα, IL-1, IL-8, MMP y RANKL.
Por ello, esta vía es cíclica.
Cada vez más citocinas inflamatorias del cuerpo conllevan al estímulo de la síntesis de citocinas inflamatorias, iniciándose así el círculo vicioso de la inflamación.
La CG-Inflendina y la CG-Flatina bloquean el enlace de TNFα en su lugar de enlace, por lo que puede detenerse también de este modo el ciclo inflamatorio.
La vía de señalización TLR4 activada por LMWHA (Ácido Hialurónico de Bajo Peso Molecular): bloqueada por la CG-Seperina (antiinflamación).
La CG-Seperina es un bloqueador de la MMP y también un inhibidor del enlace del LMWHA al sitio TLR4.
El Ácido Hialurónico de bajo peso molecular es el ácido hialurónico degradado que también causa inflamación al promover la síntesis de citocinas inflamatorias.
Cuando el LMWHA se enlaza con las TLR4, MyD88 y TRIF (moléculas de señalización) expresadas, y resultan en la expresión de las moléculas IKK, entonces la expresión de las moléculas IKK conduce a la fosforilación de NKkB.
Como resultado, se produce la síntesis de citocinas inflamatorias como la TNFα, IL-1, IL-8, MMP y RANKL.
La CG-Seperina regula a la baja la descomposición del AH, por lo que mantiene el peso molecular del HA más elevado.
Vía de señalización RANK activada por RANKL: bloqueada por CG-Bonade/CG-Dentida (Antiosteoclastogénesis).
RANKL es una citocina que promueve la osteoclastogénesis.
El osteoclasto es la forma modificada del tejido óseo y produce daños en el mismo.
El enlace de RANKL a su lugar de enlace conduce a la expresión de TRF6 →ERK, JNK→AP-1→ expresión de NFATc1.
Esta vía termina entonces con la expresión del gen que promueve la osteoclastogénesis.
La CG-Bonade y la CG-Dentida bloquean los enlaces RANKL en su lugar de enlace, inhibiendo así la osteoclastogénesis.
La efectividad en la inhibición de la osteoclastogénesis puede apreciarse en los datos C del estudio in vitro, así como también en el prospecto.
Vía de señalización BMPR activada por la CG-Bonade/CG-Dentida (Formación de hueso).
Además de inhibir RANKL, CG-Bonade y CG-Dentida se vinculan también al lugar de enlace de BMP, promoviendo la formación de hueso.
CG-Bonade y CG-Dentida pueden enlazarse al BMPR y activar la vía BMP.
Esta vía de señalización resulta en la expresión de la transcripción genética para la formación de hueso, que incluye la génesis de osteoblastos (células óseas).
Mediante esta formación de hueso, el cartílago (tejido óseo) puede regenerarse con el tiempo.
TRADD, MyD88, TRAF6, etc., son moléculas de señalización de citosol, y la expresión de cada molécula conduce a la expresión de otra molécula de señalización en la vía.
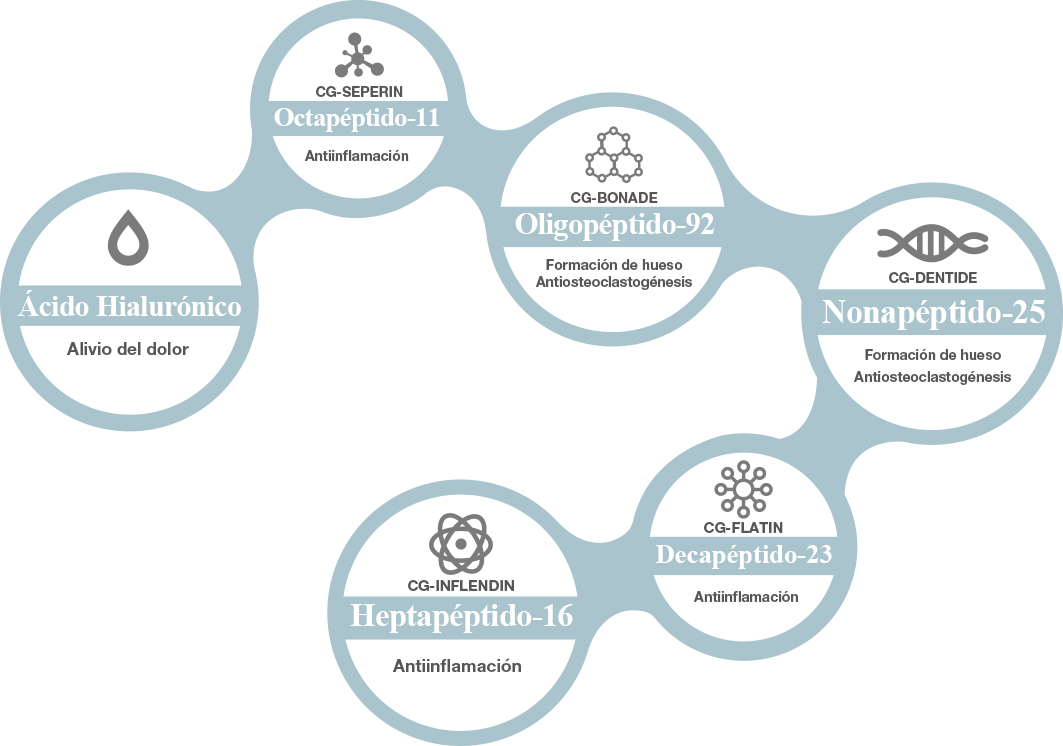
Único AH* con Péptidos Extracelulares Específicos
Matriz de similitud para una respuesta en OA
AH – API Estandarizado
El Ácido Hialurónico (AH), componente principal de matriz extracelular, se considera como uno de los elementos clave en el proceso de regeneración tisular. Se ha comprobado que modula, mediante receptores de AH específicos, la inflamación, la migración celular y la angiogénesis, que son las principales fases en la cicatrización de las heridas. Se examina el papel del AH en 2 de los principales pasos de la cicatrización de las heridas: inflamación y proceso de angiogénesis. Finalmente, se discuten las propiedades antioxidativas del AH y se presenta su eventual implicación clínica. (1)
- El Ácido Hialurónico en la inflamación y la regeneración de los tejidos. – Autores: Malgorzata Litwiniuk, Alicja Krejner, Tomasz Grzela: Marzo 2016 – Edición: Volumen 28 – Edición 3 – Marzo 2016 – ISSN: 1044-7946 – Índice: Wounds 2016; 28 (3): 78-88
https://Arthrodesmol.woundsresearch.com/article/hyaluronic-acid-inflammation-and-tissue-regeneration
Péptidos de matriz Biomimética específicos
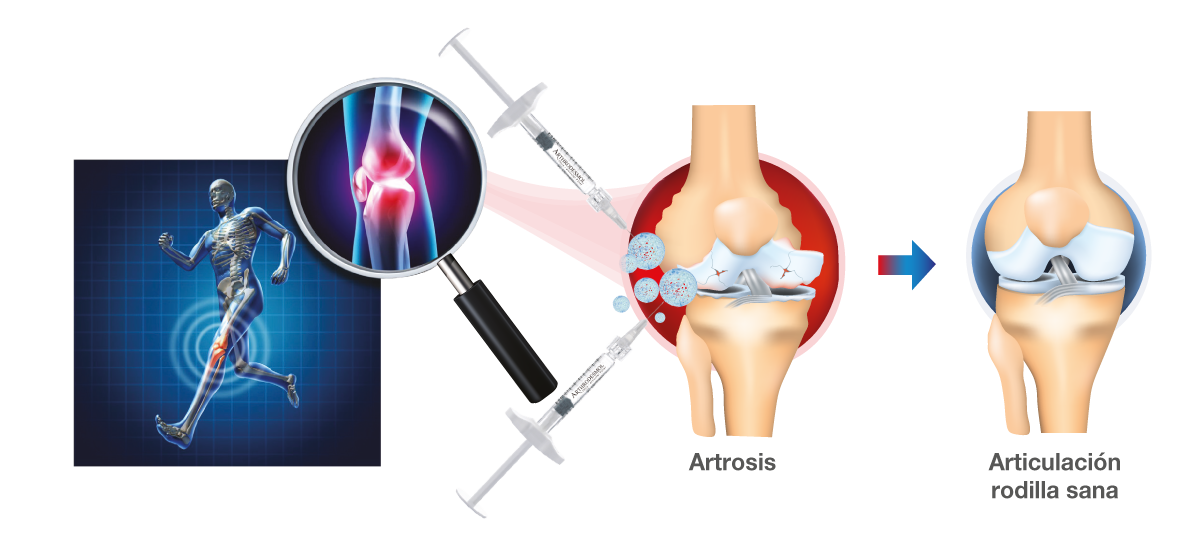
- Interrupción de la degradación del cartílago y la degeneración articular.
- Disminución de la inflamación sinovial – alivio del dolor.
- Utilización de péptidos para el bloqueo de las citocinas – Efecto antiinflamatorio y analgésico.
- Mejora del control del dolor por los péptidos, debido a la acción de diferentes mecanismos en la articulación de la rodilla.
- Comprobación, mediante estudios clínicos, de la eficacia en la disminución del dolor después de una semana frente al tratamiento convencional, que presentaba una mejora a los tres meses. (1)
Péptidos en la OA
La osteoartritis (OA) es la enfermedad articular degenerativa más común, caracterizada por la degradación del cartílago articular y la degeneración articular. El cartílago articular está principalmente formado por condrocitos y por una matriz extracelular a base de colágeno-proteoglicano que contiene altos niveles de proteínas glicosiladas. El fenotipo de la célula metastásica o glicoproteínas sialiladas como péptidos, atenúa la activación NF-kB, protegiendo los condrocitos de las agresiones artríticas que provocan la degradación del cartílago articular. (1)
Estudios recientes demuestran que el uso de péptidos combinado con un Ácdigo Hialurónico de alta calidad:
Proporciona soporte para la reparación/regeneración osteocondral de tejidos, al tiempo que confiere características mecánicas y funcionales adecuadas, así como la protección de agentes biomoleculares de la degradación prematura.
Las estrategias y desafíos actuales utilizados en la funcionalización de biomateriales con péptidos que pueden imitar las proteínas ECM u otras biomoléculas solubles naturales, importantes para inducir las complejas interacciones entre las células y el ECM, se discuten aquí. El tratamiento de la OA mediante la biofuncionalización peptídica de biomateriales puede diseñarse para ser reconocibles, inducir la diferenciación, prevenir infecciones, degradarse en una proporción prevista o actuar como sistemas de administración de fármacos para la liberación controlada o incluso como simples desencadenantes del comportamiento celular. (2)
Los enfoques de péptidos y peptidomiméticos en el tratamiento de la artritis inflamatoria son la clave que influencia una respuesta inflamatoria. Los péptidos utilizados bloquean las citocinas. (3)
La conclusión de esta revisión científica confirma que los péptidos específicos usados en el relleno intraarticular Arthrodesmol se han combinado con el AH para desarrollar péptidos transmembranales y obtener una óptima eficacia potencial en procesos degenerativos provocados por la artritis.
OCTAPÉPTIDOS
Los octapéptidos redujeron la producción de citocinas (IL-7, IL-23, IL-6 y TNF-α) y de la proteína 1 quimioatrayente de monocitos quimiocinéticos en las articulaciones de una rata artrítica o en el sobrenadante de cultivo celular sinovial, y aumentó los niveles de IFN-γ y TGF-β.
- Es eficaz en la supresión de respuestas tanto inflamatorias como de Th17 en CIA.
- Representa una nueva modalidad terapéutica para la artritis reumatoide. (4)
OLIGOPÉPTIDOS
- FORMACIÓN DE HUESO: Los resultados sugieren que el oligopéptido acídico puede ser útil para la administración de fármacos al hueso y E2-(L-Asp)6 es un buen candidato como medicamento antiosteoporótico sin presentar los efectos secundarios adversos del E2. (5)
- ANTIOSTEOCLASTOGÉNESIS: El complejo portador de shTACE/péptidos alivió los síntomas artríticos en los modelos de artritis inducida por colágeno (AIC) al demostrar efectos antiinflamatorios y antiosteoclastogénicos reforzados. (6)
- ANTIINFLAMATORIO: Este péptido inhibe las actividades biológicas de IL-6 in vitro e in vivo. Este enfoque es un desarrollo interesante entre otras estrategias destinadas a abordar la IL-6 en enfermedades inflamatorias. (7)
NONAPÉPTIDOS
- FORMACIÓN DE HUESO: este péptido se enlaza con las proteínas transmembranales para fomentar eventos intracelulares previos a las funciones celulares. Promueve la formación de hueso sin actividad antigénica reconocible alguna. Su potencial valor se dirige a la medicina regenerativa, especialmente para la ingeniería de tejidos óseos. (8)
- ANTIOSTEOCLASTOGÉNESIS: El receptor activador del factor-ḳB (RANK) nuclear y ligando RANK juegan un papel clave en el metabolismo óseo, y la focalización selectiva de la señalización RANK se ha convertido en una estrategia terapéutica prometedora en el manejo de enfermedades óseas resortivas. (9)
DECAPÉPTIDOS
- ANTIINFLAMATORIO: El decapéptido es un potente péptido antiinflamatorio que tiene aplicaciones terapéuticas potenciales, especialmente para el PLA2- en el líquido sinovial de pacientes con artritis RA inflamatoria. (10)
- ANTIOSTEOCLASTOGÉNESIS: Activa la proliferación de la respuesta específica de células T de colágeno tipo II y la formación de anticuerpos en la artritis reumatoide (AR) y sus relaciones con el subtipo HLA-DR4. (11)
HEPTAPÉPTIDOS
- ANTIINFLAMATORIO: el péptido RGD (RGD-4C) que estaba enlazado de forma covalente con un heptapétido proapoptótico se enlaza selectivamente con las integrinas αvβ3 y αvβ5 acumuladas en la sinovia inflamada, aunque no en la sinovia normal. El autoguiado del fago RGD-4C hasta la sinovia inflamada fue inhibido por la coadministración de RGD-4C soluble. Las inyecciones intravenosas de péptido 2 quimérico RGD-4C-D (KLAKLAK) redujeron de manera significativa la artritis clínica y aumentaron la apoptosis de los vasos sanguíneos sinoviales, mientras que el tratamiento con una mezcla vehicular o sin mezclar con el RGD-4C y el péptido proapoptótico sin enfocar no tuvo ningún efecto. La apoptosis enfocada de la neovasculatura sinovial puede inducir la apoptosis y suprimir la artritis clínica. Esta forma terapéutica es potencialmente útil para el tratamiento de la artritis inflamatoria. (12)